11月19日,中国科学院上海营养与健康研究所陈雁研究组在国际学术期刊Cell Reports上在线发表了题为“Blocking glycogen synthase 1 in white adipose tissue alleviates hypermetabolism following severe burn injury through inhibition of JAK2 by UDPG”的研究论文。该研究发现阻断糖原合酶1(GYS1)可以通过提高尿苷二磷酸葡萄糖(UDPG),后者直接结合JAK2蛋白,抑制烧伤后白细胞介素-6(IL-6)诱导的JAK2-STAT3信号传导,抑制白色脂肪组织的产热,并改善机体高代谢状态。
高代谢(Hypermetabolism)是一种静息能量消耗显著升高的状态,是危重疾病(包括严重烧伤、癌症恶病质和脓毒症)的标志性反应。该病症以代谢失衡为特征,表现为循环能量底物(如游离脂肪酸)的异常积聚,以及脂肪组织和骨骼肌中不受控制的分解代谢。这些改变导致全身代谢功能障碍、炎症加剧、多器官衰竭和不良临床结局。
烧伤后高代谢状态的关键驱动因素是白色脂肪组织发生"褐变"。尽管解偶联蛋白1(UCP1)介导的产热作用对适应性体温调节至关重要,但其在烧伤后的病理性激活会导致代谢消耗。研究表明该过程受到骨髓来源IL-6的显著促进。这种白色脂肪组织褐变进一步与烧伤诱导的肝脏脂肪变性相关联。
GYS1参与糖原合成过程。研究人员之前的报道指出,在寒冷或β3-激动剂刺激条件下,脂肪组织特异性Gys1基因敲除可减弱褐变反应。然而,GYS1在烧伤诱导的白色脂肪组织褐变中的作用仍属未知。
研究团队发现在烧伤后,小鼠与人类白色脂肪组织中的GYS1表达均显著上调。脂肪组织特异性Gys1基因敲除能够有效抑制烧伤引发的白色脂肪组织褐变及脂解过程,改善肝脏脂肪变性并显著提高生存率。值得注意的是,Gys1敲除并未影响棕色脂肪组织的正常产热功能,也未缓解肌肉组织的消耗现象。在分子机制上,研究人员发现Gys1缺失会促使UDPG在细胞内大量积累,这些积聚的UDPG通过不依赖β3-肾上腺素能或P2Y14受体通路的独特方式,有效抑制了IL-6诱导的JAK2-STAT3信号通路的激活。通过分子对接与表面等离子共振实验,研究团队证实了UDPG与JAK2蛋白之间存在直接的特异性结合。更重要的是,研究人员采用特异性GYS1小分子抑制剂MZ-101进行烧伤治疗,可成功模拟基因敲除的效果,显著提升脂肪组织内UDPG水平,重现包括抑制白色脂肪组织褐变、改善肝脏脂肪变性在内的多种表型改善效果,并最终显著提高烧伤实验动物的生存率。
综上,该研究首次系统阐明了GYS1-UDPG-JAK2-STAT3信号轴在烧伤后病理性白色脂肪组织褐变中的核心调控作用,并创新性地提出靶向抑制GYS1可作为治疗烧伤诱导的高代谢状态的新型治疗策略。这一发现不仅深化了人们对烧伤后代谢紊乱机制的理解,也为临床干预提供了新的潜在治疗靶点。
中国科学院上海营养与健康研究所研究员陈雁为文章的通讯作者,博士研究生卓士铉为该论文的第一作者。研究得到了科技部国家重点研发计划、国家自然科学基金委重点、以及上海市市级科技重大专项项目的资助,同时也得到了中国科学院上海营养与健康研究所所级公共技术中心分析测试技术平台、实验动物技术平台的支持。
文章链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)01349-X
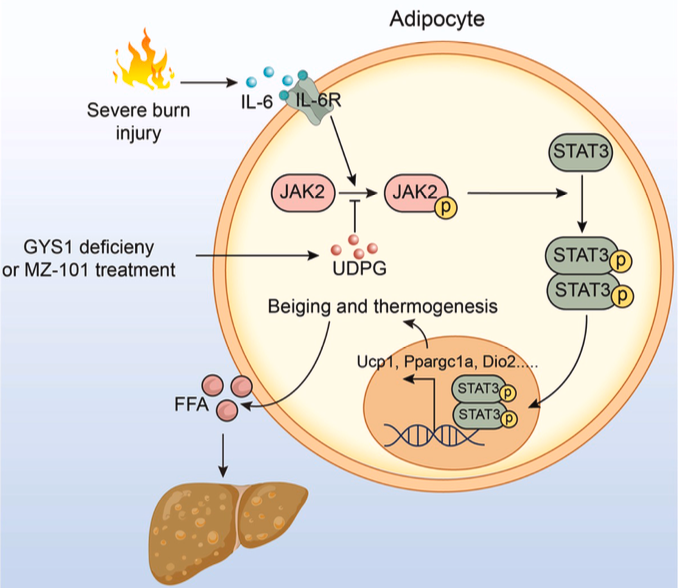
图:阻断GYS1抑制烧伤后脂肪组织产热改善机体高代谢的分子机制
推送单元:陈雁研究组、科技规划与任务处